大脑神经元“生锈”元凶找到了!Cell:GPX4 特殊结构塌陷触发铁死亡,为痴呆治疗开辟新路径
- 阿尔兹海默病
- 铁死亡
- 基因突变
- GPX4
来源:生物谷原创 2025-12-09 11:12
铁死亡可直接驱动神经退行性病变,相关研究结果不仅揭示了一种罕见儿童早发性痴呆的病因,更为理解阿尔茨海默病等常见痴呆症开辟了新视角。
想象一下,大脑中的神经元如同精密的仪器般有序运作,可某天却莫名开始 “生锈”、坏死,这并非夸张的比喻,而是一种名为铁死亡的真实细胞死亡方式。全球目前有超 5500 万人受痴呆症困扰,阿尔茨海默病是其中最常见的类型,传统研究大多将焦点放在大脑内的淀粉样蛋白斑块上,但越来越多证据表明,神经元细胞膜脂质的过氧化损伤,或许是更早启动的致病环节。
近日,发表在国际顶刊《Cell》上的研究“A fin-loop-like structure in GPX4 underlies neuroprotection from ferroptosis”中,德国赫尔姆霍兹慕尼黑中心等机构的科学家首次拿出分子级证据,证实铁死亡可直接驱动神经退行性病变,这一发现不仅破解了一种罕见儿童早发性痴呆的病因,更为阿尔茨海默病等常见痴呆症的研究开辟了全新视角。

在人体中,有一类关键的 “防锈工”——谷胱甘肽过氧化物酶 4(GPX4),它能精准清除有害的脂质过氧化物,从而保护细胞膜免于发生过氧化损伤,避免细胞陷入铁死亡。
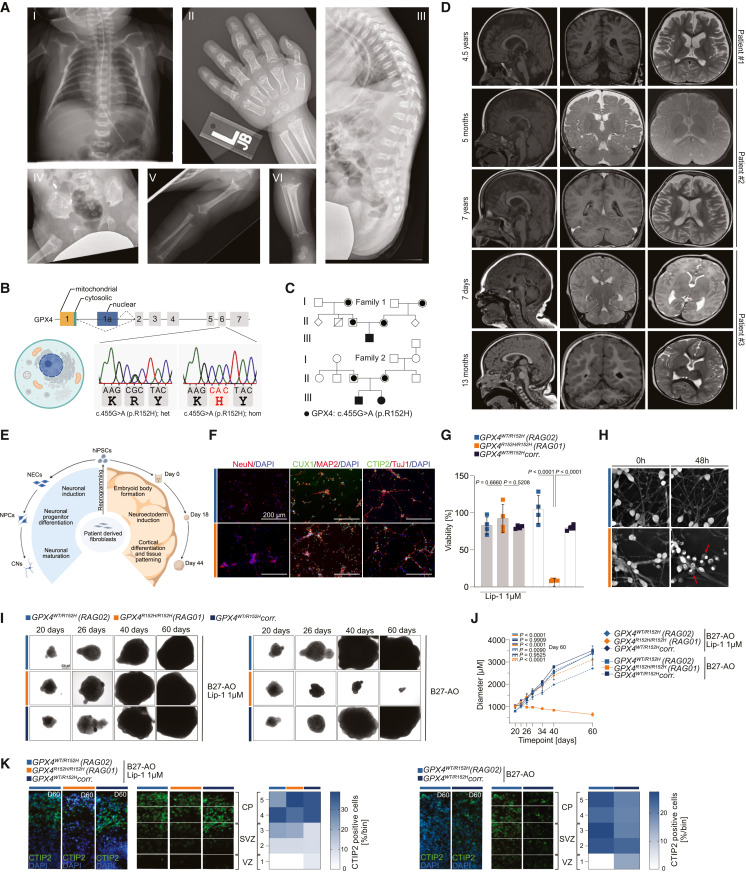
研究中,科研人员将目光聚焦在三名患有罕见早发性痴呆的美国儿童身上,他们均携带相同的GPX4基因突变(R152H)。通过深入剖析这一突变,科学家发现了一个前所未有的关键细节:GPX4蛋白上存在一个鳍状环结构,这个结构能帮助GPX4稳定锚定在细胞膜内侧,就像冲浪板的鳍插入水中一样,让GPX4可以在膜上有效 “巡逻”,及时中和膜上产生的有害物质。而 R152H 突变会直接导致这个 “鳍” 状结构塌陷,GPX4无法再稳定附着在细胞膜上,其保护功能也随之丧失;细胞膜上的脂质过氧化物开始不断累积,进而触发铁死亡,最终造成神经元不可逆的死亡。
为了验证这一机制,研究人员展开了多维度的探索。首先是患者来源的细胞与类器官模型研究,他们将患儿的体细胞重编程为诱导多能干细胞(iPSC),再将其定向分化为皮层神经元,同时构建了能模拟早期脑组织三维结构的前脑类器官。
实验结果显示,这些患者来源的神经元和类器官对铁死亡异常敏感,会呈现出神经元坏死等关键病理特征,而使用铁死亡抑制剂后,它们的存活状态能得到有效改善。其次是条件性基因敲除小鼠模型验证,研究人员在小鼠神经细胞中特异性引入GPX4 R152H 突变,或是直接敲除Gpx4基因,这些小鼠逐渐出现了严重的运动障碍,大脑皮层和小脑的神经元大量死亡,还伴随明显的神经炎症反应,这与患病儿童的临床表现高度吻合。
此外,蛋白质组学分析还带来了意外发现,对模型小鼠脑组织进行检测后,研究人员发现其蛋白质表达变化谱与阿尔茨海默病患者的脑组织高度重合,这强烈提示铁死亡应激或许在常见痴呆症的发生发展中也扮演着重要角色。
GPX4R152H等位基因或会触发铁死亡
这项研究实现了从罕见病到共性机制的重要跨越。一方面,它首次建立起 “结构缺陷—功能丧失—疾病表型” 的完整证据链,不仅锁定了GPX4的致病突变,更通过结构生物学、细胞模型、动物模型和蛋白质组学等多领域技术,系统阐明了GPX4膜锚定缺陷如何引发铁死亡,最终导致神经退行性病变的全过程。
另一方面,研究成功连接了罕见病与常见病,通过对罕见早发性痴呆的深入探究,意外揭示出铁死亡可能是多种神经退行性疾病的共性致病机制之一,为阿尔茨海默病等常见病提供了全新的病理视角和潜在干预靶点。同时,概念性的治疗验证也带来了新希望,在细胞和小鼠模型中,铁死亡抑制剂能有效减缓神经元死亡,尽管这离成熟疗法还有很长距离,却为未来开发靶向铁死亡的神经保护策略提供了关键的 “原理性证明”。
研究数据明确显示,铁死亡很可能是神经元死亡的核心驱动力,而非单纯的伴随现象,这无疑挑战了以往痴呆研究过度聚焦蛋白沉积的传统观念,将科研目光引向了更早发生的细胞膜损伤事件。不过研究人员也保持着谨慎态度,他们强调,这只是一项重要的原理验证,远非可落地的疗法,要将基础研究成果转化为临床药物,还需要经历漫长的过程,包括开发更安全的铁死亡抑制剂、优化药物递送策略以及开展严格的临床试验等。这项工作也生动证明,要真正破解痴呆这类复杂疾病,需要科研人员对基础研究进行长期投入,更离不开国际多学科团队的协同合作。
大脑的退化从来不是单一因素导致的,它更像是一场由多因素引发的 “慢性灾难”,这项研究则提醒我们,在关注大脑内蛋白质 “垃圾” 堆积的同时,或许也该留意细胞的 “围墙”——细胞膜是否健康,是否正在悄悄 “生锈”。从一枚小小的基因突变出发,科学家们揭开了铁死亡与大脑健康之间的深刻关联,这不仅为罕见病家庭带来了病因解答,也为亿万受神经退行性疾病困扰的人群,点亮了一盏全新的科研探照灯。(生物谷Bioon.com)
参考文献:
Svenja M. Lorenz,Adam Wahida,Mark J. Bostock, et al. A fin-loop-like structure in GPX4 underlies neuroprotection from ferroptosis. Cell. doi: 10.1016/j.cell.2025.11.014.
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->





